Neue Therapien stehen hierzulande so schnell und umfassend zur Verfügung wie in keinem anderen europäischen Land.
Dr. Matthias Wilken
BPI-Geschäftsführer Market Access, Märkte und Versorgung
Derzeit sind etwa 8.000 Seltene Erkrankungen bekannt, doch es gibt nur ca. 200 Arzneimittel zur Behandlung. Der therapeutische Bedarf an Arzneimitteln gegen Seltene Erkrankungen (Orphan Drugs) ist also groß. Oftmals bieten sie erstmalig eine Therapieoption und tragen erheblich dazu bei, die Lebensqualität von Patientinnen und Patienten zu verbessern.
Das Besondere an der Forschung zu Seltenen Erkrankungen ist, dass auch Menschen mit anderen Erkrankungen von den Ergebnissen profitieren können. Denn das gewonnene Wissen über das Krankheitsgeschehen einer Seltenen Erkrankung lässt sich oft auch auf andere Krankheitsbilder übertragen. Umso mehr Faktoren eines Krankheitsverlaufs bekannt sind, desto eher können pharmazeutische Unternehmen spezifische Therapien entwickeln.
Die Entwicklung eines neuen Orphan Drugs ist jedoch sehr herausfordernd. Sie kann bis zu 15 Jahre dauern und mehrere hundert Millionen bis Milliarden Euro kosten. Bereits die Vorbereitung und Durchführung von Studien (Datengenerierung) sind aufwendig: Will ein Unternehmen Therapieansätze für eine Seltene Erkrankung erforschen, sucht es nach der Stecknadel im Heuhaufen. Zudem sind die Patientenpopulationen klein, heterogen und geografisch oft weit verteilt.
Die Rekrutierung von Probanden ist daher sehr schwierig und kostenintensiv, was wiederum mit einem hohen Investitionsrisiko für pharmazeutische Unternehmen einhergeht. Da Hersteller diese Kosten refinanzieren müssen und der Absatzmarkt durch die kleinen Patientenpopulationen stark begrenzt ist, sind höhere Preise die Folge.
Trotz dieser Herausforderungen können Patientinnen und Patienten in Deutschland positiv gestimmt sein: Neue Therapien stehen hierzulande so schnell und umfassend zur Verfügung wie in keinem anderen europäischen Land.
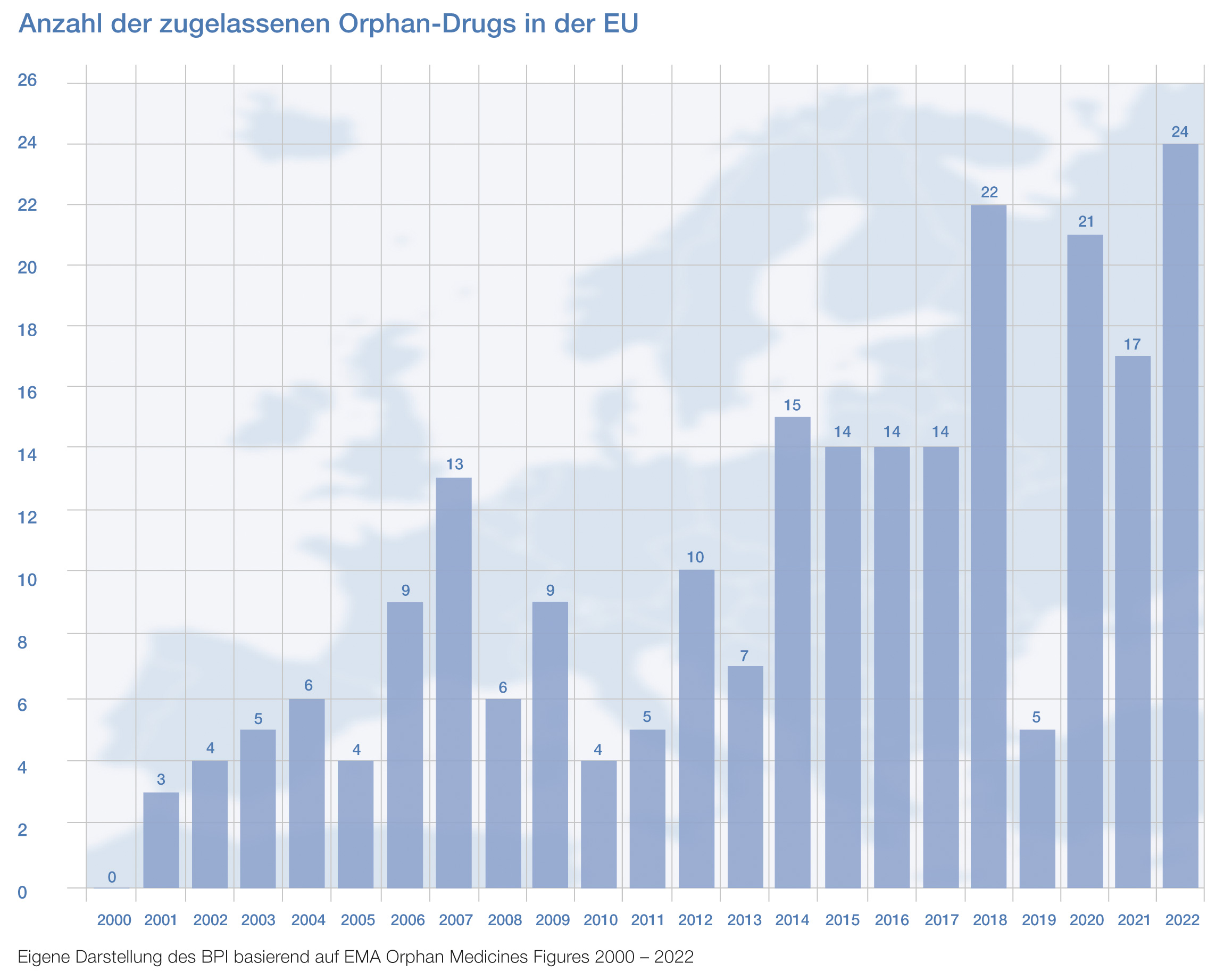
Es ist jedoch wichtig, dass der Arzneimittelmarkt preispolitisch so aufgestellt bleibt, dass Unternehmen in der Lage sind, auch zukünftig Therapien für nur wenige Patientinnen und Patienten zu entwickeln. Stabile politische Rahmenbedingungen sind dafür entscheidend.
Leider weisen aktuelle Entwicklungen in eine andere Richtung: Auf europäischer Ebene werden Einschnitte im Anreizsystem zur Entwicklung von Orphan Drugs diskutiert. Und auch auf nationaler Ebene wird der sozialrechtliche Sonderstatus immer wieder in Frage gestellt.
Die aktuelle Bundesregierung sieht hier Handlungsbedarf: Im Koalitionsvertrag kündigt sie an, die gesundheitliche Situation von Betroffenen Seltener Erkrankungen, zum Beispiel durch Ausbau und Stärkung von digital vernetzten Zentren, zu verbessern.
Als Bundesverband der Pharmazeutischen Industrie (BPI) begrüßen wir dieses Signal und fordern weiterhin verbindliche Rahmenbedingungen. Gerade vor dem Hintergrund der angespannten Finanzlage der Gesetzlichen Krankenversicherung dürfen Patientinnen und Patienten mit Seltenen Erkrankungen nicht ins Hintertreffen geraten.
Um diesen Prozess ganzheitlich zu gestalten, engagieren wir uns im Nationalen Aktionsbündnis für Menschen mit Seltenen Erkrankungen (NAMSE). Gemeinsam mit Bundesministerien und knapp 30 Bündnispartnern setzen wir uns dafür ein, dass Patientinnen und Patienten mit einer Seltenen Erkrankung eine zeitnahe Diagnose und Therapie erhalten.
Bei seltenen Erkrankungen handelt es sich oft um genetisch bedingte Erkrankungen, oft sind Kinder betroffen.
Für viele schwerkranke Patientinnen und Patienten, bei denen andere Therapien oft ausgeschöpft sind, können mitunter Arzneimittel für neuartige Therapien (ATMP) zum Einsatz kommen.
Weitere Informationen zum Thema finden Sie im BPI-Themendienst „ATMP“ und im BPI-Themendienst „Seltene Erkrankungen“
Weitere Informationen finden Sie unter:
www.bpi.de




