Die x-chromosomale Hypophosphatämie (kurz XLH) ist eine seltene Störung des Knochenstoffwechsels, die durch eine Mutation vererbt wird, welche auf dem X-Chromosom liegt und zu einem Phosphatmangel führt. Wir sprachen mit Sabrina Hauck*, die selbst betroffen ist und zwei erkrankte Kinder hat.
Frau Hauck, Sie und Ihre Kinder sind betroffen von XLH. Wann und wie hat sich die Erkrankung bei Ihnen geäußert?
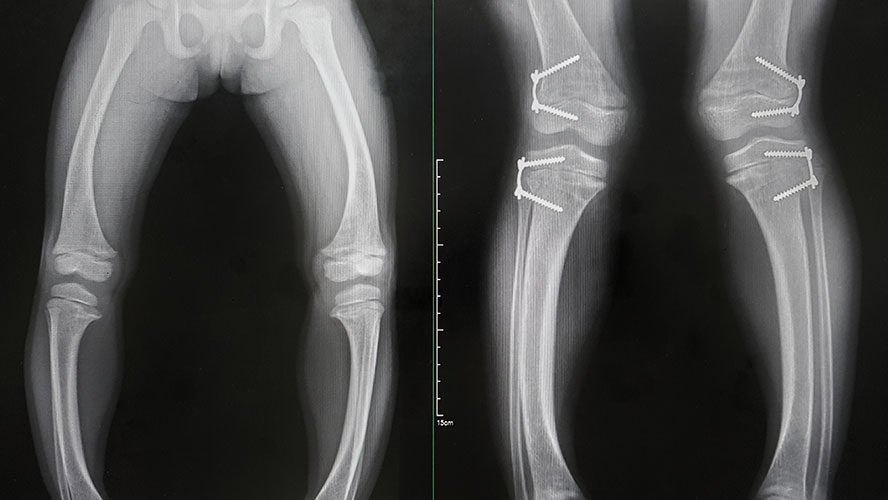
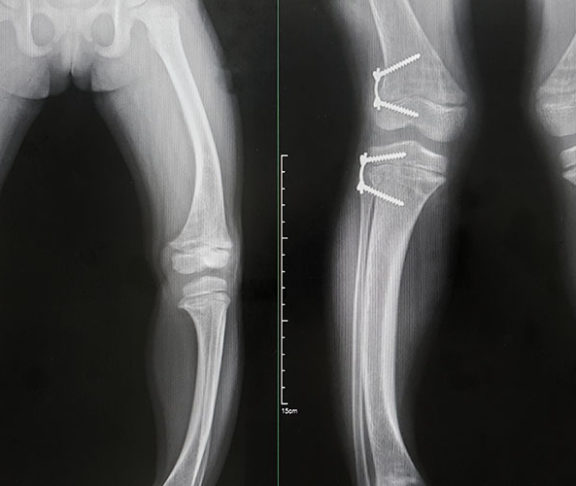
Meinen Eltern ist schon recht früh aufgefallen, dass etwas nicht stimmt, da war ich wenige Wochen alt. Seit ich sechs Wochen alt war, wurde ich in der Orthopädie einer Uniklinik behandelt. Rein orthopädisch. Zuerst war es die Hüfte, dann, als ich – sehr spät – mit dem Laufen begann, entwickelten sich sofort die für eine XLH-Erkrankung typischen X-Beine. Diese Verkrümmung der Knochen wird durch den für die Erkrankung charakteristischen Phosphatmangel verursacht: Da die Knochen nicht ausreichend mineralisiert sind, härten vor allem die langen Röhrenknochen nicht richtig aus und verkrümmen sich. In der Klinik wurde diese mit vielen Korrekturoperationen begradigt, doch zunächst ohne dauerhaften Erfolg. Ohne Medikation, die eine Diagnose voraussetzt, werden die Knochen schnell wieder krumm, man bleibt klein und hat weiterhin starke Schmerzen. Auch können z.B. Schwerhörigkeit, Schädeldeformationen oder Zahnprobleme auftreten. Die Krankheitslast ist enorm. Erst kurz vor meinem zwölften Geburtstag, als schon der nächste OP-Termin stand, wurde ich richtig diagnostiziert.
Wie wurden Sie dann behandelt?
Ab diesem Zeitpunkt bekam ich große Mengen an Phosphat und Vitamin D. Das Präparat musste ich dann in möglichst kleinen Dosen verteilt über den Tag einnehmen. Meine Knochen waren ab diesem Zeitpunkt wesentlich stabiler, ich hatte weniger Schmerzen und war insgesamt viel fitter. Allerdings hat das Medikament vermehrt Verdauungsstörungen ausgelöst, was viele Patienten beklagen, die so behandelt werden. Als Dauerzustand unter lebenslanger Therapie ist das eine furchtbare Sache. Seit einigen Monaten bekomme ich ein neues Medikament, das bei Erwachsenen nur alle vier Wochen verabreicht werden muss. Das erleichtert mir das Leben, zudem sind nun auch die Nebenwirkungen verschwunden.
War es durch Ihre Vorgeschichte leichter, auch der Erkrankung Ihrer Kinder auf die Spur zu kommen?
Mein Mann und ich hatten das von Anfang an auf dem Schirm. Bei Geburt unseres ersten Kindes war die genetische Diagnostik aber noch nicht so weit, dass man zweifelsfrei hätte feststellen können, ob unser Kind betroffen ist. Als unser Kind acht Monate alt war, konnte man meine Werte aber nochmals analysieren und feststellen, wo genau die Mutation liegt, und in diesem Zuge wurde auch unser Kind diagnostiziert. Bei unserem zweiten Kind stand die Diagnose dann bereits nach sechs Wochen.
Wie wirkt sich die Erkrankung auf Ihren Familienalltag aus?
Unsere Kinder wurden früh diagnostiziert und behandelt, dennoch haben sie Symptome. Körperlich wirkt sich die Erkrankung bei unseren Kindern sehr unterschiedlich aus. Ein Kind hatte schon im Kleinkindalter die XLH-typischen Zahnprobleme, in Form von Abszessen, Fisteln und Zahnverlusten. Es mussten fünf Backenzähne in Vollnarkose entfernt werden, das ist für ein so kleines Kind eine Tortur. Das andere Kind ist zahngesund, hat aber eine Muskelschwäche und ist körperlich nicht so belastbar. Für die Kinder und uns als Familie waren und sind die zahllosen Termine bei Ärzten und Therapeuten, und die stets ermüdenden Verhandlungen mit der Krankenkasse, sehr quälend. Das Anderssein durch die Erkrankung belastet die Kinder zudem. Die Umstellung auf das neue Medikament, das bei Heranwachsenden alle zwei Wochen verabreicht werden muss, führte gerade bei unseren Teenagern zu einer verbesserten Lebensqualität. Trotzdem kann die Therapie nicht alles verhindern. Das Leben mit XLH ist weiter beschwerlich und von Schmerzen geprägt.
Welche Rolle spielt für Sie die Vernetzung mit anderen Betroffenen?
Für meine Kinder war es wichtig, andere betroffene Kinder kennenzulernen. Für uns als Eltern spielt der Austausch eine ebenso wichtige Rolle: man kann Vergleiche ziehen, Informationen austauschen, sich Tipps geben. Und natürlich stärkt der Zusammenhalt sehr: dadurch, dass man plötzlich zu Vielen ist, hat diese seltene Erkrankung eine viel größere Aufmerksamkeit bekommen, wir sprechen nun mit einer starken Stimme.
Phosphatdiabetes e. V.
Die Patientenorganisation Phosphatdiabetes e.V. ist eine Gemeinschaft von Betroffenen und Angehörigen, die Informationen bereitstellt, Hilfestellung anbietet und durch persönlichen Erfahrungsaustausch im Umgang mit der Erkrankung unterstützt. Die Belange aller Altersstufen – von Kindern, Jugendlichen und Erwachsenen – finden Beachtung.
Weitere Informationen unter www.phosphatdiabetes.de
*Name von der Redaktion geändert